Algunas propiedades periodica
tamaño atomo el radio ionico, energia de ionizacion electro negatividad
Que es radio atomico.
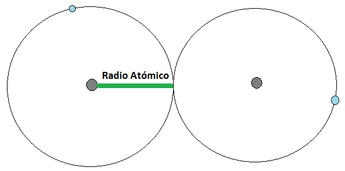
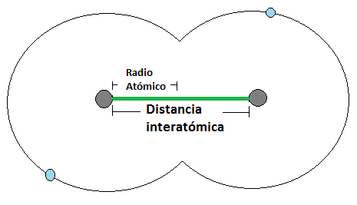
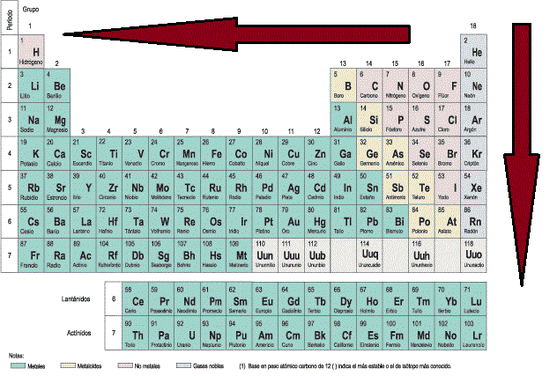
Radio Atómico: El radio atómico se define como la distancia media que existe entre los núcleos atómicos de dos átomos que se encuentren unidos mediante un enlace (los enlaces atómicos se verán en detalle un poco más adelante). Para los átomos que se unan mediante una cesión de electrones, el radio atómico correspone a la distancia indicada en la Imágen 12 (a) [izquierda], mientras que los que se unan mediante una compartición de electrones, el radió atómico se representa tal y como apárece en laImágen 12 (b) [derecha]. Para esta consideración se considera al átomo como una esfera. El radio atómico aumenta a medida que se aumenta en el período y a medida que se baja en el grupo (Imágen 13).
Imágen 12: Radio Atómico. Las pelotas grises son los núcleos atómicos, mientras las bolas celestes son el electrón mas externo.
(a)
(b)
Imágen 13: Direcciones hacia donde aumenta el Radio
A que llamamos radio ionico
El radio ionico es el radio que tiene un atomo cuando ha ganado electrones. adquiriendo estructura electronica.
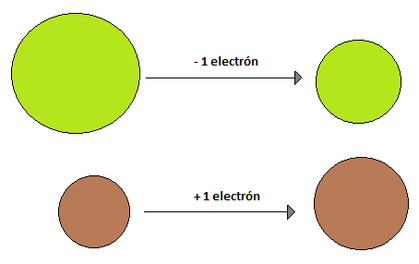
Radio Iónico: El radio iónico se define en relación a iones. Un ión es una especie química con carga, ya sea esta positiva o negativa, y se originan debido a que los elementos tratan de parecerse al gas noble más cercano (elementos del grupo 18), ya que estos tienen una estabilidad sueprior debido a que sus niveles energéticos se encuentran completos. El término ión significa "ir hacia" y hace referencia a un circuito eléctrico, es por eso que las sustancias cargadas positivamente se llaman cationes (van hacia el cátodo , polo negativo) y las sustancias cargadas negativamente se llaman aniones (van hacia el ánodo, polo positivo). Pero, ¿qué hace que exista esta especie química cargada? La respuesta es la ganancia o pérdida de electrones. Como un átomo es electricamente neutro, cuando, por ejemplo, gana un electrón de más queda con cargado con un -1 mientras que si pierde un electrón queda cargado con un +1. La capacidad de un átomo para ganar o perder electrones esta dado por su electronegatividad, electropositividad, energía de ionización y electroafinidad (propiedades que se verán más adelante). El radio iónico de una especie que ha perdido un electrón es menor que el radio atómico original, esto se debe a que como existe una carga positiva más que negativas, los electrones se sienten mucho mas atraídos hacia el núcleo, reduciendo el radio. Por su parte, cuando un elemento gana un electrón, su radio iónico es mayor que su radio atómico de origen, debido a que ese último electrón que entró no se encuentra tan atraído hacia el núcleo y hace aumentar el radio (Imágen 14). El radio iónico, al igual que su par atómico, aumenta a medida que se "baja" en un grupo, pero a diferencia del radio atómico, no presenta una tendencia clara de crecimiento en un periodo, ya que depende del ión (y algunos elementos tienen más de un ión posible, como Cu, Fe, Mn, etc.) (Imágen 15).
Imágen 14: Comparaciones entre los radios iónicos (derecha) con respecto a sus radios atómicos originales, (izquierda) para un elemento cualquiera que gane un electrón y otro cualquiera que pierda uno.
QUE ES ENERGIA DE IONIZACION.
Las energías de ionización de los átomos aislados dependen de tres factores principales: a) La carga nuclear (dada por el número atómico, Z), puesto que cuanto mayor sea Z, mayor es la fuerza de atracción que ejerce el núcleo sobre los electrones y por tanto más difícil es extraerlos. b) El número cuántico principal, n, del estado energético en que se encuentre el electrón, puesto que cuando mayor sea n, menos ligado se encuentra el electrón al núcleo. c) El efecto de pantalla de los electrones internos, dado que el electrón que se encuentra situado en la última capa se ve sometido a la acción repulsiva de los electrones internos.

Las energías de ionización, medidas en átomos aislados, informan de la estabilidad de las estructuras electrónicas del átomo. En términos generales, los metales tienen poca atracción por sus electrones periféricos, por lo que tienen energías de ionización bajas frente a los no metales.
A la izquierda se ha representado la variación de la primera energía de ionización (medida en eV/átomo) de los elementos representativos de los tres primeros periodos del Sistema Periódico. Como se observa, en cada periodo la tendencia general es que la energía de ionización aumenta al aumentar el número atómico. Esto es así porque al aumentar el número atómico en un periodo, se incrementa el número de electrones existentes en un mismo nivel energético (sin cambiar el número cuántico principal) y aumenta al mismo tiempo la carga efectiva del núcleo (Z). Por lo tanto, se intensifica la interacción atractiva entre el electrón menos ligado y el núcleo. Por estas razones, los metales alcalinos (grupo I) son los elementos con menor energía de ionización. En el extremo opuesto, los gases nobles son, con mucho, los elementos con mayor energía de ionización, al tener las estructuras electrónicas más estables.

Respecto a la variación de la primera energía de ionización dentro de cada familia, la tendencia general es que dicha energía disminuye al aumentar el número atómico. Al aumentar el número atómico dentro de una familia, aumenta el número de niveles y cambia el número cuántico principal. El último electrón está a una distancia mayor del núcleo y el resto de electrones (más internos) ejercen sobre él un gran poder de apantallamiento. Aunque también aumenta la carga nuclear, la intensidad de la interacción núcleo-electrón se resiente.
El gráfico de la izquierda muestra la variación de la energía de ionización en los elementos alcalinos. En las otras familias, la tendencia es análoga.
Nos referimos ahora a las energías de ionización posteriores a la primera (recuérdese que la primera energía de ionización es la mínima energía que hay que suministrar a un átomo neutro, en su estado fundamental, para arrancarle el primer electrón; la segunda energía de ionización es la energía precisa para sustraer el segundo electrón y así sucesivamente). Lógicamente, la primera energía de ionización, que corresponde a la extracción del electrón más alejado del núcleo, es la menor; la segunda es mayor que la primera; la tercera mayor que la segunda; y así sucesivamente. A medida que se extraen electrones, los que quedan son más atraídos por el núcleo (que no cambia), puesto que se encuentran más próximos a él, y sufren menos repulsión por el apantallamiento de los electrones restantes, colocados por debajo de ellos.

Ahora bien, la variación de las sucesivas energías de ionización de un elemento químico no es regular. Precisamente, fue el descubrimiento de que había grandes saltos en el valor de estas energías lo que hizo concebir la idea de una estructura electrónica en capas o niveles de energía. El cambio de nivel energético (conlleva la disminución del número atómico principal, n) del electrón extraído, se corresponde con un gran aumento de energía de ionización.
A la izquierda se representan los valores de sucesivas energías de ionización (E1, E2, E3,..) de algunos átomos. Los saltos más bruscos se dan entre las energías de electrones de dos niveles de energía diferentes (por ejemplo, para el Be el salto más brusco se da entre la segunda energía de ionización (2s1) y la tercera (1s2).
Las energías de ionización de los átomos aislados dependen de tres factores principales: a) La carga nuclear (dada por el número atómico, Z), puesto que cuanto mayor sea Z, mayor es la fuerza de atracción que ejerce el núcleo sobre los electrones y por tanto más difícil es extraerlos. b) El número cuántico principal, n, del estado energético en que se encuentre el electrón, puesto que cuando mayor sea n, menos ligado se encuentra el electrón al núcleo. c) El efecto de pantalla de los electrones internos, dado que el electrón que se encuentra situado en la última capa se ve sometido a la acción repulsiva de los electrones internos.
Las energías de ionización, medidas en átomos aislados, informan de la estabilidad de las estructuras electrónicas del átomo. En términos generales, los metales tienen poca atracción por sus electrones periféricos, por lo que tienen energías de ionización bajas frente a los no metales.
A la izquierda se ha representado la variación de la primera energía de ionización (medida en eV/átomo) de los elementos representativos de los tres primeros periodos del Sistema Periódico. Como se observa, en cada periodo la tendencia general es que la energía de ionización aumenta al aumentar el número atómico. Esto es así porque al aumentar el número atómico en un periodo, se incrementa el número de electrones existentes en un mismo nivel energético (sin cambiar el número cuántico principal) y aumenta al mismo tiempo la carga efectiva del núcleo (Z). Por lo tanto, se intensifica la interacción atractiva entre el electrón menos ligado y el núcleo. Por estas razones, los metales alcalinos (grupo I) son los elementos con menor energía de ionización. En el extremo opuesto, los gases nobles son, con mucho, los elementos con mayor energía de ionización, al tener las estructuras electrónicas más estables.
Respecto a la variación de la primera energía de ionización dentro de cada familia, la tendencia general es que dicha energía disminuye al aumentar el número atómico. Al aumentar el número atómico dentro de una familia, aumenta el número de niveles y cambia el número cuántico principal. El último electrón está a una distancia mayor del núcleo y el resto de electrones (más internos) ejercen sobre él un gran poder de apantallamiento. Aunque también aumenta la carga nuclear, la intensidad de la interacción núcleo-electrón se resiente.
El gráfico de la izquierda muestra la variación de la energía de ionización en los elementos alcalinos. En las otras familias, la tendencia es análoga.
Nos referimos ahora a las energías de ionización posteriores a la primera (recuérdese que la primera energía de ionización es la mínima energía que hay que suministrar a un átomo neutro, en su estado fundamental, para arrancarle el primer electrón; la segunda energía de ionización es la energía precisa para sustraer el segundo electrón y así sucesivamente). Lógicamente, la primera energía de ionización, que corresponde a la extracción del electrón más alejado del núcleo, es la menor; la segunda es mayor que la primera; la tercera mayor que la segunda; y así sucesivamente. A medida que se extraen electrones, los que quedan son más atraídos por el núcleo (que no cambia), puesto que se encuentran más próximos a él, y sufren menos repulsión por el apantallamiento de los electrones restantes, colocados por debajo de ellos.
Ahora bien, la variación de las sucesivas energías de ionización de un elemento químico no es regular. Precisamente, fue el descubrimiento de que había grandes saltos en el valor de estas energías lo que hizo concebir la idea de una estructura electrónica en capas o niveles de energía. El cambio de nivel energético (conlleva la disminución del número atómico principal, n) del electrón extraído, se corresponde con un gran aumento de energía de ionización.
A la izquierda se representan los valores de sucesivas energías de ionización (E1, E2, E3,..) de algunos átomos. Los saltos más bruscos se dan entre las energías de electrones de dos niveles de energía diferentes (por ejemplo, para el Be el salto más brusco se da entre la segunda energía de ionización (2s1) y la tercera (1s2).
La electronegatividad de un elemento mide su tendencia a atraer hacia sí electrones, cuando está químicamente combinado con otro átomo.
No hay comentarios:
Publicar un comentario